GenSight Biologics confirme l’efficacité et la sécurité durables des injections bilatérales de LUMEVOQ® quatre ans après une administration unique
- Efficacité maintenue 4 ans après l’injection dans le cadre de l’étude de phase III REFLECT
- Maintien du bénéfice à 4 ans chez les patients traités bilatéralement : amélioration cliniquement significative d’au moins 15 lettres par rapport à leur nadir observé
- 73 % des patients traités bilatéralement présentent un niveau d’amélioration cliniquement significatif
- Profil de sécurité favorable confirmé à 4 ans



PARIS--(BUSINESS WIRE)--Regulatory News:
GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible au PEA-PME), une société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies rétiniennes neurodégénératives et les troubles du système nerveux central, a publié aujourd’hui les premiers résultats d’efficacité et de sécurité à 4 ansa après l’administration du traitement dans le cadre de REFLECT, une étude de phase III portant sur LUMEVOQ® (GS010 ; lenadogene nolparvovec). Les résultats montrent que l’amélioration de l’acuité visuelle s’est maintenue avec un profil de sécurité favorable quatre ans après une administration unique de la thérapie génique. L’injection bilatérale offre un effet supplémentaire par rapport au traitement unilatéral, démontré dans toutes les analyses de l’amélioration de l’acuité visuelle et des taux de répondeurs.
« Les dernières données de l’étude REFLECT confirment que l’amélioration observée avec lenadogene nolparvovec se maintient 4 ans après l’administration du traitement, ainsi que le bénéfice supplémentaire observé chez les participants recevant une injection intravitréenne bilatérale de thérapie génique », a déclaré Patrick Yu-Wai-Man, MD, PhD, professeur d’ophtalmologie à l’Université de Cambridge et au Moorfields Eye Hospital, et investigateur principal international de REFLECT. « Par ailleurs, les participants de l’étude REFLECT ayant reçu une injection bilatérale présentaient un profil de sécurité comparable aux participants traités unilatéralement. »
Les observations renforcent les résultats observés à 3 ans après l’administration du traitement rapportés en mars 2023b.
Efficacité durable et significative à l’Année 4
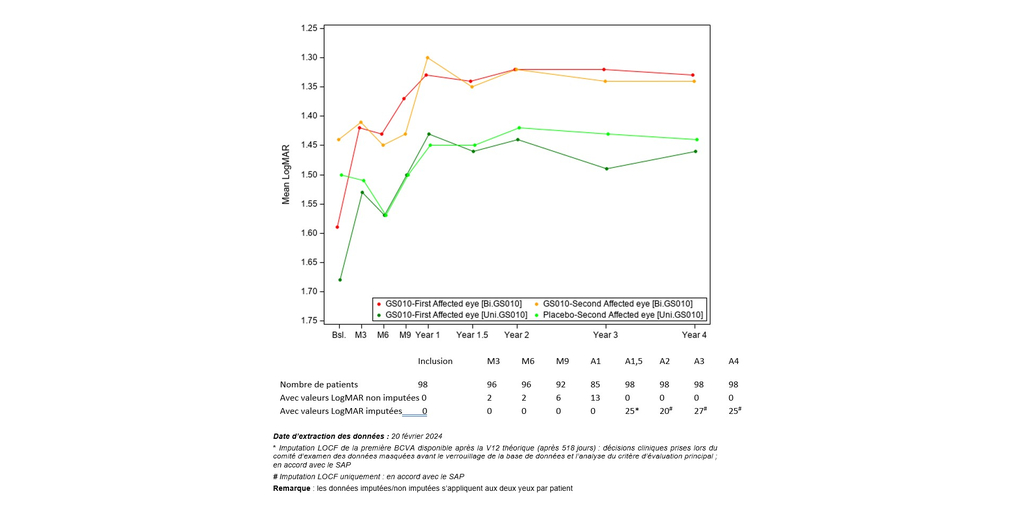
L’évolution de l’acuité visuelle au fil du temps montre que l’amélioration visuelle après traitement par lenadogene nolparvovec s’est maintenue sur 4 ans chez tous les patients, l’acuité visuelle des patients ayant reçu une injection bilatérale restant meilleure que celle des patients ayant reçu une injection unilatérale. Cet écart est observé depuis l’Année 1,5.
Graphique 1 : Évolution de la meilleure acuité visuelle corrigée (BCVA) au fil du temps — Étude REFLECT de phase III
(Voir Graphique 1)
Par rapport au nadir (c.-à-d. la BCVA la plus basse enregistrée entre l’inclusion et l’Année 4), l’acuité visuelle moyenne pour tous les yeux traités par LUMEVOQ a augmenté au-delà du seuil de +15 lettres, qui définit conventionnellement une amélioration cliniquement significative. L’amélioration des yeux des patients ayant reçu le placebo met en évidence l’effet controlatéral du traitement constamment observé dans toutes les études cliniques (également documenté dans les yeux traités par sham dans les études REVERSE1 et RESCUE2).
« L’effet durable sur la vision, observé dans l’essai clinique REFLECT, est une pièce essentielle du parcours de LUMEVOQ pour les patients, les médecins et les autorités de santé », a commenté Laurence Rodriguez, directrice générale de GenSight Biologics. « L’impact durable d’une administration unique différencie la thérapie génique des autres modalités de traitement en facilitant l’observance des patients et en améliorant la qualité de vie. »
Tableau 1 : Variation de la meilleure acuité visuelle corrigée (BCVA) par rapport au nadir 4 ans après l’injection
| 4 ans | |
1er œil atteint | 2e œil atteint | |
Patients ayant reçu une injection bilatérale de LUMEVOQ® |
LUMEVOQ®
|
LUMEVOQ®
|
Patients ayant reçu une injection unilatérale de LUMEVOQ® |
LUMEVOQ®
|
PLACEBO
|
Date d’extraction des données : 20 février 2024. Patients traités bilatéralement : 1er œil affecté : n=48 ; 2e œil affecté : n=48 ; patients traités unilatéralement : 1er œil affecté : n=50 ; 2e œil affecté : n=50. p<0,0001 pour tous les groupes d’yeux basé sur un modèle mixte linéaire. | ||
Les analyses des répondeurs renforcent l’observation de l’amélioration clinique des patients, pour lesquels l’évolution naturelle entraîne généralement une altération importante de la vision avec une très faible probabilité de récupération spontanée.3 Quatre ans après une injection bilatérale, 73 % des patients présentaient une amélioration cliniquement significative d’au moins -0,3 LogMAR (+15 lettres ETDRS) par rapport à leur nadir observé. Quatre-vingt-un pour cent (81 %) des patients traités bilatéralement sont capables de lire des lettres à l’écran (vision « on-chart »), la probabilité d’atteindre ce niveau de vision étant deux fois plus élevée avec un traitement bilatéral qu’avec une injection unilatérale (rapport de probabilité : 2,0 [0,7 ; 5,5]).
Profil de sécurité favorable
Le profil de sécurité favorable de LUMEVOQ® a continué à être confirmé et a été démontré comme étant comparable chez les patients traités bilatéralement et unilatéralement. Aucun arrêt de l’étude lié à des événements indésirables systémiques ou oculaires et aucun événement indésirable oculaire grave n’ont été enregistrés. Le principal événement indésirable oculaire était une inflammation intraoculaire, généralement légère, et répondant au traitement conventionnel.
REFLECT est une étude de phase III randomisée, en double insu, contrôlée contre placebo, incluant 98 patients présentant une perte visuelle due à une neuropathie optique héréditaire de Leber (NOHL) causée par un gène mitochondrial ND4 muté ; les patients ND4 inclus présentaient une perte visuelle jusqu’à un an depuis son apparition. Tous les patients ont reçu une injection intravitréenne (IVT) de lenadogene nolparvovec dans leur premier œil affecté. Le deuxième œil affecté a été randomisé pour recevoir une deuxième IVT de LUMEVOQ® ou une IVT de placebo, qui a été administrée le même jour ou le jour suivant. 48 patients ont été randomisés pour recevoir un traitement bilatéral par LUMEVOQ®, et 50 pour recevoir un traitement unilatéral par lenadogene nolparvovec (premier œil affecté traité par LUMEVOQ®, deuxième œil affecté traité par placebo). Les patients REFLECT seront suivis jusqu’à 5 ans après l’injection afin de surveiller l’efficacité et la sécurité de LUMEVOQ® au fil du temps.
Références :
|
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intravitréenne dans chaque œil.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas.
À propos de LUMEVOQ® (GS010 ; lenadogene nolparvovec)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision à Paris, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018. LUMEVOQ® (GS010 ; lenadogene nolparvovec), n'a été enregistré dans aucun pays à ce stade.
À propos de REFLECT
REFLECT est une étude multicentrique, randomisée, en double aveugle, contrôlée versus placebo visant à évaluer l’efficacité et la tolérance des injections bilatérales de LUMEVOQ® (GS010 ; lenadogene nolparvovec) chez des sujets atteints par la NOHL en raison de la mutation NADH déshydrogénase 4 (ND4). Dans le bras actif, LUMEVOQ® a été administré en une seule injection intravitréenne dans les deux yeux de chaque sujet. Dans le bras placebo, LUMEVOQ® a été administré en une seule injection intravitréenne dans le premier œil affecté, tandis que l’autre œil a reçu une injection placebo.
Le critère d’évaluation principal de l’étude REFLECT est l’acuité visuelle (Best Corrected Visual Acuity ou BCVA) mesurée en LogMAR 1,5 an après le traitement du deuxième œil affecté / non encore affecté. La variation par rapport à la baseline dans les deuxièmes yeux affectés / non encore affectés recevant LUMVOQ® et le placebo est le critère principal d’évaluation. Les critères d’efficacité secondaires incluent : variation par rapport à la ligne de base du BCVA mesurée en LogMAR 2, 3, 4 et 5 ans après le traitement du deuxième œil affecté / non encore affecté par rapport au placebo et au premier œil affecté recevant LUMEVOQ®, variation par rapport à la baseline de l’OCT, sensibilité aux contrastes et échelles de qualité de vie.
L’essai a inclus 98 sujets ayant commencé à perdre la vision depuis moins d’un an, et est mené dans plusieurs centres en Europe/UK (1 en France, Espagne, Italie et Angleterre), aux États-Unis (6 centres) et à Taïwan (1 centre).
L'essai prévoyait de recruter 90 sujets souffrant d'une perte de vision d'une durée maximale d'un an ; 98 sujets ont été sélectionnés et traités.
Le premier patient a été traité en mars 2018, et le dernier en juillet 2019. Le suivi à long-terme est en cours.
Identifiants ClinicalTrials.gov :
REFLECT: NCT03293524
a Date d’extraction des données : 20 février 2024 |
b « GenSight Biologics confirme le maintien de l’efficacité et de la tolérance d’une injection bilatérale de LUMEVOQ® après 3 ans dans l’essai de phase III REFLECT », communiqué de presse financière, 13 mars 2023 |
Contacts
GenSight Biologics
Directeur Administratif et Financier
Ivan Tortet
itortet@GENSIGHT-BIOLOGICS.com
LifeSci Advisors
Relations avec les Investisseurs
Guillaume van Renterghem
gvanrenterghem@lifesciadvisors.com
+41 (0)76 735 01 31
