GenSight Biologics annonce de nouvelles données de vraie vie issues des programmes d’Accès Précoce de la thérapie géniques LUMEVOQ® au Congrès de NANOS 2024
- Amélioration cliniquement significative de l'acuité visuelle confirmée dans une situation en vie réelle : l’acuité visuelle moyenne, « off-chart » avant injection (baseline), atteint un niveau « on-chart » à 9 mois après injection.
- Les yeux des patients traités bilatéralement s’améliorent plus que ceux des patients traités unilatéralement : +23 lettres ETDRS contre +18 lettres ETDRS, avec un taux de réponse plus élevé (63 % contre 58 %), avec un profil de sécurité similaire et favorable.
PARIS--(BUSINESS WIRE)--Regulatory News:



GenSight Biologics (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique spécialisée dans le développement et la commercialisation de thérapies géniques innovantes pour les maladies neurodégénératives rétiniennes et les troubles du système nerveux central, annonce aujourd'hui que les données récentes de vraie vie recueillies prospectivement dans le cadre de programmes d'accès précoce (EAP) de LUMEVOQ® confirment le bénéfice de la thérapie génique chez les patients atteints de neuropathie optique héréditaire de Leber liée à la mutation ND4 (ND4-LHON), comme observé lors des essais cliniques.
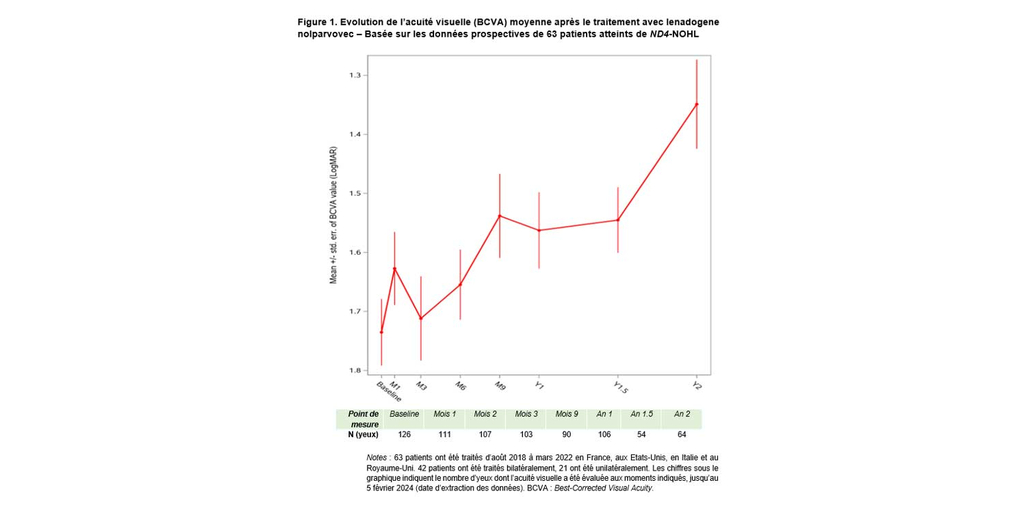
Un an après le traitement, les yeux des patients injectés bilatéralement ont enregistré une amélioration moyenne de l’acuité visuelle (BCVA) par rapport au nadir1 équivalente à +23 lettres ETDRS, dépassant ainsi l'amélioration moyenne de +18 lettres observée chez les patients ayant reçu une seule injection. Dans les deux groupes, l’amélioration clinique a dépassé la définition conventionnelle de l’amélioration cliniquement significative, pour laquelle un gain de 15 lettres est considéré comme cliniquement significatif. Le profil de sécurité de la thérapie génique reste favorable et comparable entre les patients traités bilatéralement et ceux traités unilatéralement.
Les résultats ont été présentés lors du congrès 2024 de la North American Neuro-Ophthalmology Society (NANOS) et seront partagés lors d'autres grandes conférences médicales en Europe et aux États-Unis dans le courant de l'année. Le docteur Chiara La Morgia, MD, PhD, IRCCS Institut des sciences neurologiques de Bologne et Université de Bologne, Italie, a présenté les résultats lors du congrès de NANOS et a commenté : "Il est très rassurant pour les cliniciens de noter qu’avec de nouvelles données successivement disponibles, nous continuons à voir de façon cohérente une amélioration visuelle significative chez la plupart des patients traités par le lenadogene nolparvovec. Cette démonstration devient de plus en plus solide, ce qui est pertinent pour les patients qui sont frappés par une maladie sévère et cécitante telle que la NOHL."
Les dernières analyses peuvent s'appuyer sur un échantillon plus solide que la première description des données publiées en mars 20232. En particulier, l’amélioration observée un an après le traitement et au-delà permet une représentation plus définitive de la trajectoire ascendante de l’acuité visuelle moyenne (voir Figure 1).
Un an après le traitement, les analyses des répondeurs montrent que l’amélioration visuelle se manifeste pour la majorité des patients : 63,2 % des yeux des patients traités bilatéralement ont atteint un niveau d'amélioration de l’acuité visuelle cliniquement significatif (≥0,3 LogMAR ou +15 lettres ETDRS), de même que 57,9 % des yeux des patients ayant reçu une injection unilatérale. Neuf mois après l'injection, l'acuité visuelle moyenne correspondait à une vision « on-chart » (capable de lire des lettres sur l’écran), comparée à l'acuité visuelle moyenne « off-chart » (ne peut lire aucune lettre sur l’écran) à la baseline.
Les résultats de tolérance obtenus dans les EAP étaient cohérents avec ceux observés dans les études cliniques, montrant un profil de sécurité favorable de lenadogene nolparvovec. Notamment, les cas d'inflammation intraoculaire rapportés dans les yeux traités par LUMEVOQ® étaient comparables, en termes de fréquence, d'intensité et de localisation, à ceux observés dans les études cliniques.
“Constater des résultats comme ceux-ci dynamise la volonté de l'équipe GenSight à rétablir la disponibilité de l'accès précoce pour les patients éligibles d'ici le T3 de cette année,” a déclaré Laurence Rodriguez, Directeur Général de GenSight. “Au fur et à mesure que les preuves s'accumulent, démontrant que l'accès à LUMEVOQ apporte des avantages aux patients atteints de NOHL, dans le cadre des essais cliniques et dans la vie réelle, nous explorons toutes les options pour mettre LUMEVOQ à la disposition des patients dès que possible.”
LUMEVOQ® (GS010 ; lenadogene nolparvovec) a été mis à disposition dans les pays concernés via les EAPs sur la base de demandes spontanées de cliniciens, et quand son usage était autorisé par les autorités locales. The Société vise la reprise du programme de l’Autorisation de l’accès compassionnel (AAC) en France en T3 2024.
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intravitréenne dans chaque œil.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas.
À propos de LUMEVOQ® (GS010 ; lenadogene nolparvovec)
LUMEVOQ® (GS010 ; lenadogene nolparvovec) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision à Paris, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne des Médicaments (EMA) en octobre 2018. LUMEVOQ® (GS010 ; lenadogene nolparvovec), n'a été enregistré dans aucun pays à ce stade.
| _______________________________ |
1 Nadir : la plus basse acuité visuelle enregistrée entre la baseline (moment du traitement) et le point d’intérêt dans le temps (moment de l’évaluation) |
2 « GenSight Biologics annonce la présentation des données d’efficacité et de tolérance de LUMEVOQ® issues des programmes d’Accès Précoce pour les patients atteints de NOHL-ND4 au Congrès 2023 du NANOS », communiqué de presse financière, 15 mars 2023 |
Contacts
GenSight Biologics
Directeur Administratif et Financier
Ivan Tortet
itortet@GENSIGHT-BIOLOGICS.com
LifeSci Advisors
Relations avec les Investisseurs
Guillaume van Renterghem
gvanrenterghem@lifesciadvisors.com
+41 (0)76 735 01 31
