Cybin reçoit la désignation de thérapie innovante de la FDA pour sa molécule psychédélique CYB003 et annonce des données de durabilité positives à quatre mois pour le traitement du trouble dépressif majeur
- La désignation de thérapie innovante (« BTD ») offre une procédure d'évaluation accélérée, ainsi qu’un accès renforcé aux directives de la Food and Drug Administration (« FDA ») des États-Unis sur la conception des essais, avec le potentiel de réduire sensiblement les délais de développement des médicaments -
- Première désignation BTD accordée par la FDA pour une thérapie à base psychédélique d’appoint pour le traitement du trouble dépressif majeur -
- Amélioration robuste, soutenue et statistiquement significative des symptômes dépressifs à quatre mois avec 75 % des patients en rémission après deux doses (16 mg) -
- Réduction impressionnante de 22 points en moyenne sur l’échelle de notation de la dépression de Montgomery-Asberg (« MADRS ») entre le niveau de référence et à quatre mois -
- Les données appuient la progression vers une étude multinationale pivot de Phase 3 pour CYB003 dans le trouble dépressif majeur à la mi-2024 -
- La réalisation des jalons accélère et réduit les risques du programme de développement CYB003 -
- La société organisera une webdiffusion pour discuter des mises à jour du programme CYB003 aujourd’hui à 8h30 ET -
Ce communiqué de presse constitue un « communiqué de presse désigné » aux fins des suppléments du 23 août 2023 au prospectus simplifié de base de Cybin daté du 17 août 2023, tel que modifié le 22 décembre 2023.
TORONTO--(BUSINESS WIRE)--Cybin Inc. (NYSE American:CYBN) (Cboe CA:CYBN) (« Cybin » ou la « société »), une société biopharmaceutique de stade clinique qui s'engage à révolutionner les soins de santé mentale en développant des options innovantes de traitement psychédélique de prochaine génération, annonce aujourd’hui que la FDA a accordé la désignation BTD à CYB003, son analogue deutéré de la psilocybine propriétaire en développement pour le traitement d'appoint du trouble dépressif majeur. En cas d'approbation par la FDA, CYB003 serait le premier traitement d'appoint à base d'un psychédélique pour le traitement du trouble dépressif majeur.
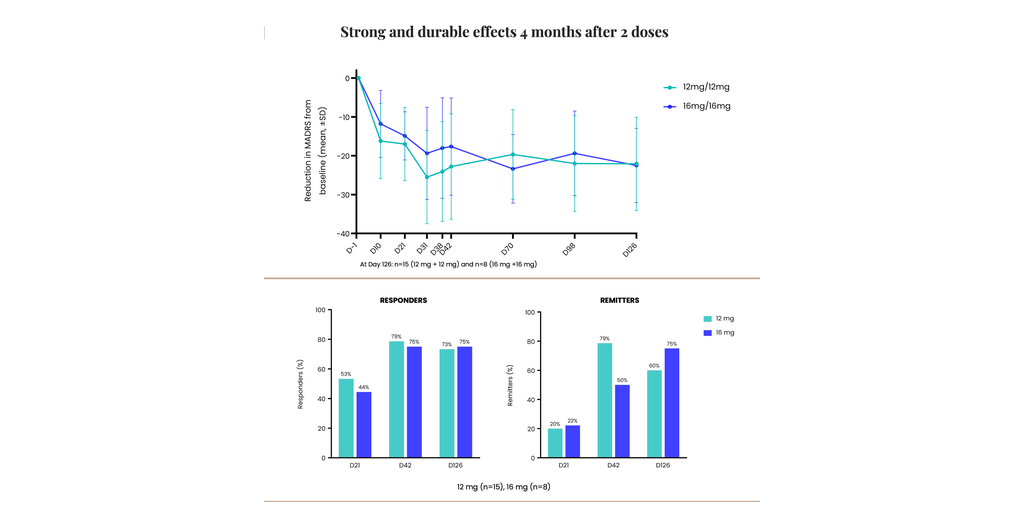



La société a également annoncé que son essai de Phase 2 pour CYB003 dans le traitement du trouble dépressif majeur a démontré une amélioration robuste et soutenue des symptômes dépressifs à quatre mois, 75 % des participants ayant reçu deux doses de 16 mg atteignant une rémission et ne présentant plus de signes de dépression.
Ces jalons importants reflètent l’engagement de la société à promouvoir des options de traitement pionnières pour le trouble dépressif majeur, marquant ainsi un moment charnière dans l'obtention de l’approbation réglementaire.
La désignation de thérapie innovante accélère et réduit les risques de la procédure6
La désignation BTD fournit une procédure d’évaluation accélérée, ainsi qu’un accès accru aux directives de la FDA sur la conception des essais, avec le potentiel de réduire les délais de développement de médicaments. Cette désignation est réservée aux médicaments candidats qui ciblent des maladies graves et démontrent une amélioration sensible sur un critère cliniquement significatif par rapport aux thérapies disponibles. La désignation comprend toutes les fonctionnalités du programme « fast track », ainsi qu'un accompagnement renforcé de la FDA et une discussion sur le programme de développement CYB003, y compris les essais cliniques planifiés et les plans visant à accélérer la stratégie de fabrication.
La désignation de CYB003 en tant que thérapie innovante reconnaît l'important besoin médical non satisfait pour des traitements plus efficaces du trouble dépressif majeur et soutient le potentiel de CYB003 pour des améliorations significatives par rapport aux thérapies existantes. La désignation BTD sert de validation des progrès de la société à ce jour et devrait accélérer la mission de Cybin de faire progresser son traitement propriétaire de nouvelle génération vers l’approbation de nouveaux médicaments sur une base accélérée.
Cette désignation est corroborée par les résultats positifs de l’étude de Phase 2 de la société sur le CYB003 dans le traitement du trouble dépressif majeur, qui a démontré une amélioration supérieure des symptômes dépressifs par rapport aux antidépresseurs approuvés et aux données récemment signalées avec d’autres psychédéliques.1
« Il s'agit d'un témoignage du travail acharné et du dévouement de toute l’équipe de Cybin que nous avons accompli en si peu de temps. L’octroi de la désignation de thérapie innovante par la FDA souligne le potentiel de CYB003 pour combler une lacune dans les options de traitement du trouble dépressif majeur et sert à accélérer et à réduire les risques de notre programme de développement à l’avenir », déclare Doug Drysdale, directeur général de Cybin. « Cette désignation prévoit un processus d’évaluation rationalisé et un engagement accru avec la FDA. Avec les données robustes sur la durabilité de notre étude de Phase 2, nous sommes prêts à avancer rapidement. Nous sommes reconnaissants pour l’opportunité d’accélérer le processus d’élaboration et d’examen réglementaire que cette désignation offre, alors que nous nous préparons à faire progresser CYB003 vers un essai pivot de Phase 3 vers le milieu de l’année. »
« Les traitements standard actuellement disponibles contre le trouble dépressif majeur peuvent être limités en termes d’efficacité, de rémission et de taux de réponse, ce qui représente des défis pour les patients et les praticiens de la santé mentale. CYB003 peut avoir le potentiel de relever ces défis, et avec la désignation BTD de la FDA, la procédure réglementaire est accélérée », déclare le Dr Maurizio Fava, M.D., président du service de psychiatrie et psychiatre en chef du Massachusetts General Hospital.
Données positives sur l’efficacité à quatre mois pour CYB003
-
amélioration robuste et soutenue des symptômes dépressifs avec deux doses de 12 mg ou 16 mg de CYB003 :
- réduction moyenne dans le score total MADRS d’environ 22 points par rapport au niveau de référence dans les deux groupes posologiques.
- environ 75 % des patients ont présenté une réponse (>/= 50 % d’amélioration des scores MADRS) après deux doses de 16 mg.
- 60 % des patients avec 12 mg et 75 % avec 16 mg étaient en rémission après deux doses (score MADRS </= 10).
Innocuité et tolérabilité :
- CYB003 a été bien toléré sans aucun événement indésirable grave lié au médicament.
- tous les événements indésirables étaient d’intensité légère ou modérée.
- aucun incident d’idée ou de comportement suicidaire.
- aucune interruption en raison d’événements indésirables.
« La réduction soutenue des symptômes dépressifs à quatre mois après seulement deux doses de CYB003 est une étape critique, qui démontre la durabilité de la réponse, suite à l’amélioration rapide des symptômes. Il ouvre également la voie à un changement dans le paradigme de traitement du trouble dépressif majeur. Contrairement aux traitements d’appoint actuellement approuvés qui nécessitent une posologie chronique quotidienne, CYB003 permet un dosage intermittent sans les défis liés à l'abandon des médicaments existants », déclare Amir Inamdar, MBBS, DNB (Psych), MFPM, Chief Medical Officer, Cybin. « En particulier, les données sur la durabilité ont montré qu’à quatre mois, environ 75 % des patients présentaient une réponse, ce qui signifie qu’ils ont obtenu une amélioration de 50 % ou plus dans leurs scores MADRS. Avec les deux doses, nous avons également observé qu’à quatre mois, 60 % des patients recevant 12 mg et 75 % recevant 16 mg ont obtenu un score MADRS inférieur ou égal à 10, indiquant qu’ils étaient en rémission et ne présentaient plus de signes de dépression. Compte tenu de ces résultats positifs, nous nous réjouissons à la perspective de faire progresser le programme et d’apporter un soutien et des alternatives thérapeutiques aux millions de personnes qui peuvent en bénéficier », conclut M. Inamdar.
« Il est vraiment remarquable qu’à quatre mois, les participants ont présenté une réduction soutenue et une amélioration progressive des symptômes dépressifs », poursuit Drysdale. « Cette réduction moyenne impressionnante par rapport au niveau de référence dans le score total MADRS était d’environ 22 points à quatre mois (comparé à une réduction moyenne de 14 points par rapport au placebo et de 17 points par rapport au niveau de référence à trois semaines). Il est très encourageant, en particulier pour les patients qui n’ont pas présenté de réponse aux options de traitement existantes. Nous nous réjouissons à la perspective de lancer notre essai de Phase 3, qui devrait être une étude multisite internationale visant à évaluer plus en profondeur l'innocuité et l’efficacité des gélules de CYB003 dans une plus grande population de patients atteints de trouble dépressif majeur. » Au fur et à mesure que nous faisons avancer ce programme, nous sommes fiers de montrer la voie et de contribuer au nombre croissant de preuves scientifiques soutenant le potentiel thérapeutique des médicaments psychédéliques pour traiter une multitude de troubles de santé mentale », conclut Drysdale.
Le MADRS est une échelle de dix points gérée par un clinicien, conçue pour mesurer la gravité globale des symptômes dépressifs chez les sujets atteints de trouble dépressif majeur. Il est largement utilisé dans les essais cliniques et accepté par les autorités réglementaires du monde entier comme mesure des symptômes de la dépression. Le MADRS comprend des éléments comme la tristesse, la réduction du sommeil et de l’appétit, ainsi que les difficultés de concentration, l’anhédonie, et les pensées négatives et suicidaires qui sont notés de 0 à 6, ce qui donne un score total allant de 0 à 60. Les plages de score typiques pour la gravité sont les suivantes : 0-6 normal ; 7-19 léger ; 20 à 34 modéré ; et >34 dépression sévère. Dans l’étude CYB003, les scores totaux moyens de référence sur l'échelle MADRS allaient de 31,4 à 33,7 dans le groupe actif et de 30,8 dans le groupe placebo.
Important besoin médical non satisfait dans la dépression
La dépression est la principale cause d’invalidité due à la maladie mentale2 et touche plus de 300 millions de personnes dans le monde.3 Malgré l’utilisation de traitements actuellement disponibles tels que les inhibiteurs sélectifs de la recapture de la sérotonine (« SSRI »), jusqu’à deux tiers des patients souffrant de dépression n’obtiennent pas de rémission avec un traitement antidépresseur initial.4 Plus de 43 millions d’Américains prennent des antidépresseurs et plus de 70 % de ces personnes sont traitées par SSRI.5 La désignation BTD de CYB003 en tant que thérapie d’appoint pour le trouble dépressif majeur souligne le besoin urgent de combler cette lacune de traitement, étant donné qu'une proportion importante de personnes ne sont pas soulagées par les thérapies existantes.
Informations relatives à la téléconférence et à la webdiffusion :
Date : mercredi 13 mars 2024
Heure : 8h30 ET
Accès téléphonique : 800-267-6316 (gratuit depuis les États-Unis) ou 203-518-9783 (international)
Identification de la conférence : CYBN0313
Webdiffusion : inscrivez-vous à la webdiffusion ici
La webdiffusion archivée sera également disponible sur le site Web des relations avec les investisseurs de la société sur la page Events & Presentations.
Remarques :
- Stone et al. (2022) Response to acute monotherapy for major depressive disorder in randomized, placebo-controlled trials submitted to the US Food and Drug Administration: individual participant data analysis. BMJ (Clinical research ed.), 378, e067606.
- GBD 2019 Diseases and Injuries Collaborators (2020). Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 396: 1204–22.
- Friedrich M. J. (2017). Depression Is the Leading Cause of Disability Around the World. JAMA, 317(15), 1517. https://doi.org/10.1001/jama.2017.3826.
- Rush et al. Am J Psychiatry 2006; 163:1905–1917.
- Sood et al. (2023). Selective serotonin reuptake inhibitor use, age-related neuropathology and cognition in late-life. Psychiatry Research 328.
- Rien ne garantit que les délais seront respectés. Les délais prévus concernant la mise au point de médicaments sont fondés sur des hypothèses raisonnables fondées sur les connaissances et l’information actuelles dont dispose la société. Ces déclarations sont fondées, entre autres, sur des lignes directrices réglementaires pour l’élaboration d’un médicament comportant des études d’innocuité, des études de preuve de concept et des études pivots pour la présentation et l’approbation de nouvelles demandes de médicaments, et supposent le succès de la mise en œuvre et des résultats de ces études sur les délais indiqués comme possible par ces lignes directrices, d’autres exemples sectoriels et les efforts de développement de la société à ce jour.
À propos de Cybin
Cybin est une société biopharmaceutique de phase clinique dont la mission est de créer des thérapies à base de psychédéliques sûre et efficaces pour résoudre les immenses besoins non satisfaits des options de traitements nouveaux et innovants de personnes qui souffrent de conditions mentales.
L'objectif de Cybin de révolutionner les soins de santé mentale est soutenu par un réseau de partenaires de classe mondiale et de scientifiques de renommée internationale visant à faire progresser les plateformes de découverte de médicaments exclusifs, les systèmes d'administration de médicaments innovants, les nouvelles approches de formulation et les régimes de traitement. La Société développe actuellement CYB003, un analogue deutéré de la psilocybine propriétaire pour le traitement du trouble dépressif majeur, et CYB004, une molécule DMT deutérée propriétaire pour le traitement des troubles anxieux généralisés, et dispose d'un portefeuille de recherche sur des composés psychédéliques expérimentaux.
Basé au Canada et fondé en 2019, Cybin opère au Canada, aux États-Unis, au Royaume-Uni, aux Pays-Bas et en Irlande. Suivez toute l'actualité de Cybin sur www.cybin.com et suivez l'équipe sur X, LinkedIn, YouTube et Instagram.
Mises en garde et déclarations prospectives
Certaines déclarations figurant dans le présent communiqué de presse relatif à la S société ont un caractère prévisionnel. Les déclarations prospectives ne sont pas basées sur des faits historiques, mais sur des attentes actuelles et des projections d'évènements futurs et sont par conséquent soumises aux risques et incertitudes qui pourraient faire que les résultats réels diffèrent considérablement des résultats futurs exprimés ou impliqués dans les déclarations prospectives. Ces déclarations peuvent être identifiées de façon générale par l'emploi de verbes tels que « pouvoir », « devoir », « avoir l'intention de », « estimer », « prévoir », « anticiper », « s'attendre à », « penser que » ou « continuer », les conjugaisons au futur et au conditionnel, ou les formes négatives ou des variations similaires de ces verbes. Les déclarations prospectives du présent communiqué de presse comprennent des déclarations relatives aux essais cliniques planifiés par la société et aux plans visant à accélérer la stratégie de fabrication et de développement de CYB003 ; le potentiel pour CYB003 d’apporter une amélioration significative par rapport aux thérapies existantes ; la progression de CYB003 vers un essai de Phase 3 à la mi-2024 ; la réduction potentielle des délais de développement de médicaments accordés par la désignation DTD ; et les plans de la société pour concevoir des plateformes propriétaires de découverte de médicaments, des systèmes novateurs d’administration de médicaments, de nouvelles approches de formulation et des schémas de traitement pour les troubles de santé mentale.
Ces déclarations prospectives sont fondées sur des hypothèses raisonnables et des estimations de la direction de la société au moment de l’établissement des déclarations. Les résultats futurs peuvent en différer sensiblement car les déclarations prospectives impliquent des risques connus et inconnus, des incertitudes et d'autres facteurs qui peuvent faire en sorte que les résultats, les performances ou les réalisations de Cybin diffèrent sensiblement des résultats, des performances ou des réalisations exprimés ou sous-entendus dans ces déclarations prospectives. Parmi ces facteurs figurent les répercussions de la propagation de la COVID-19 sur les activités de la société ; les fluctuations des conditions macroéconomiques générales ; les fluctuations des marchés boursiers ; les attentes concernant la taille du marché des substances psychédéliques ; la capacité de la société à atteindre ses objectifs commerciaux ; les plans de croissance ; les incertitudes politiques, sociales et environnementales ; les relations avec les employés, la présence de lois et de réglementations pouvant imposer des restrictions sur les marchés où opère Cybin et les facteurs de risque énoncés dans le rapport de gestion de la société pour le trimestre et les neufs mois clos au 31 décembre 2023 et dans la notice annuelle de la société pour l'exercice clos au 31 mars 2023, qui sont disponibles sous le profil SEDAR+ de la société à l'adresse www.sedarplus.com et auprès de la Securities and Exchange Commission des États-Unis sur EDGAR à l'adresse www.sec.gov. Bien que les déclarations prospectives figurant dans le présent communiqué de presse soient fondées sur ce que la direction de la société estime (ou estimait au moment) être des hypothèses raisonnables, la société ne peut garantir aux actionnaires que les résultats réels seront conformes à ces déclarations prospectives, car d'autres facteurs peuvent faire en sorte que les résultats ne soient pas conformes aux prévisions, aux estimations ou aux intentions. Le lecteur ne doit pas se fier indûment aux déclarations et informations prospectives contenues dans le présent communiqué de presse. La société rejette toute obligation de mettre à jour les déclarations prospectives concernant les opinions, les projections ou d'autres facteurs, si ceux-ci venaient à changer, sauf si la loi l'exige.
Cybin ne fait aucune allégation médicale, de traitement ou de prestations de santé sur ses produits. Ni la FDA, ni Santé Canada ni aucune autre autorité réglementaire n'a évalué les affirmations concernant la psilocybine, les tryptamines psychédéliques, les dérivés de tryptamine ou d'autres composés psychédéliques. L'efficacité de ces produits n'a pas été confirmée par des recherches approuvées. Il n'existe aucune garantie que l'utilisation de la psilocybine, de la tryptamine psychédélique, des dérivés de tryptamine ou d'autres composés psychédéliques puisse diagnostiquer, traiter, guérir ou prévenir toute maladie ou condition. Des recherches scientifiques rigoureuses et des essais cliniques sont nécessaires. Cybin n'a pas mené d'essais cliniques pour l'utilisation de ses produits candidats. Toute référence à la qualité, la cohérence, l'efficacité et l’innocuité des produits potentiels n'implique pas que Cybin ait vérifié de tels éléments dans le cadre d'essais cliniques, ni que Cybin réalisera de tels essais. Si Cybin ne parvient pas à obtenir les approbations ou les recherches nécessaires pour commercialiser ses produits, cela pourrait avoir un effet néfaste majeur sur les performances et les opérations de Cybin.
Ni Cboe Canada ni la bourse NYSE American LLC n'a approuvé ou désapprouvé le contenu de ce communiqué de presse ; celles-ci ne pourraient être tenues responsables de l’exactitude et de la pertinence de ce communiqué de presse.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Investisseurs et médias :
Gabriel Fahel
Chief Legal Officer
Cybin Inc.
1-866-292-4601
irteam@cybin.com – ou – media@cybin.com
